2024年11月11日,我院番文春课题组在微生物学旗舰刊物《PLOS Pathogens》发表题为“TRIM32 inhibits Venezuelan equine encephalitis virus infection by targeting a late step in viral entry”的研究论文,鉴定了宿主E3泛素连接酶TRIM32作为一个新颖的甲病毒限制因子。

番文春课题组聚焦人重要RNA病毒与宿主互作机制研究,课题组建立新颖的病毒—宿主互作研究体系(阵列CRISPR、ORF文库和邻近标记联合蛋白质谱等)来挖掘调控病毒感染的关键宿主因子,结合病毒学、细胞生物学、分子生物学与生物化学等研究手段揭示其分子机制,利用动物或类器官模型揭示宿主因子与病毒感染致病的体内相关性。
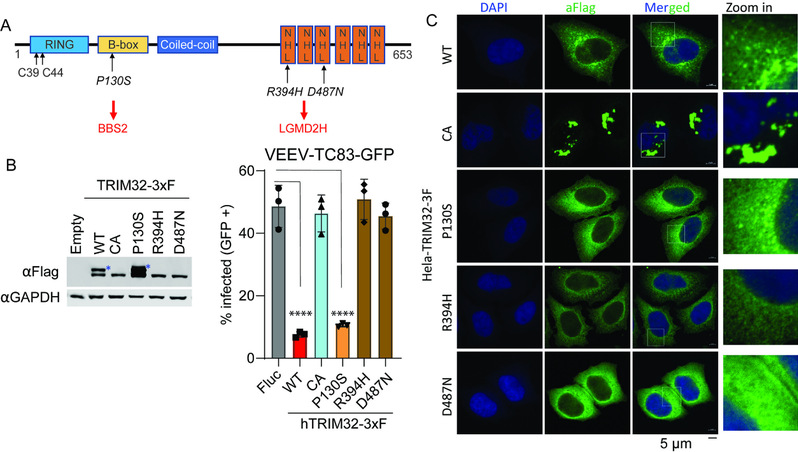
在本研究中,利用课题组建立的“双色荧光流式细胞筛选”策略,分析了118个人RING型E3泛素连接酶对一种由蚊子传播的致脑炎甲病毒——委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus vaccine strain TC83, VEEV-TC83,人畜共患,尚无FDA批准的疫苗或特异性抗病毒药物)复制的影响,鉴定到TRIM32作为一个新颖的甲病毒(Alphavirus)宿主限制因子。研究中发现TRIM32可抑制多种蚊媒传播甲病毒的复制,包括辛德毕斯病毒(SINV,引起脑炎)和阿良良病毒(ONNV,引起关节炎),而对寨卡病毒(ZIKV,蚊子传播)和柯萨奇病毒B3(CVB3,肠道病毒,粪口传播)无抑制作用。分子机制探索中发现TRIM32对VEEV-TC83的抑制作用不依赖TRIM32-STING-IFN抗病毒信号通路,而是特异性靶向病毒进入细胞后脱衣壳(uncoating)到病毒蛋白翻译的过程,但具体分子细节仍待解析。值得注意的是,研究中还发现TRIM32的病理突变体R394H和D487N(与肢带型肌营养不良症2H型相关)丧失了对甲病毒的抑制功能,且该表型与TRIM32的单泛素化修饰存在重要关联(见下图所示)。未来相关动物模型的建立将有助于探究TRIM32病理突变与甲病毒感染致病的体内相关性。总之,该研究丰富了我们对宿主泛素蛋白酶体系统与病毒相互作用的认识。
番文春课题组博士研究生谢逸凡、曹婕和甘淑仪为共同第一作者,番文春研究员和UT Southwestern Medical Center John W. Schoggins博士为共同通讯作者。本研究受国家自然科学基金、威廉(中国)启动经费、浙江大学基本科研业务费的资助(项目负责人:番文春)。课题组成员钱苏红博士、博士研究生张东杰,浙江大学实验动物中心徐令东博士、浙江大学医学院第二附属医院徐峰博士、清华大学医学院丁强博士对本项目提供重要支持和协助;感谢威廉(中国)生物成像平台和清华大学蛋白质化学与组学平台的支持。
原文资源和连接:PMID: 39527628, PMCID: PMC11581401, DOI: 10.1371/journal.ppat.1012312