2023年11月9日,我院林世贤课题组与芝加哥大学何川课题组及其深圳湾实验室葛韵课题组合作在Nature Cell Biology上发表题为“O-GlcNAcylation determines the translational regulation and phase separation of YTHDF proteins”的研究论文。该研究采用翻译后修饰的化学定量检测技术,解析了O-GlcNAc修饰水平对YTHDF蛋白的翻译促进功能与相分离性质的调控机制,提出了YTHDF1/3可逆调控m6A-RNA翻译的完善模型,解释了YTHDF蛋白功能研究争议的本质原因。(图1)YTHDF1/3的可逆糖基化调控机制将营养感知的糖基化修饰与m6A-mRNA的翻译及胞内相分离直接联系在了一起。这一机制将在外界营养条件发生显著变化的生理和病理过程(例如糖尿病过程)中调控细胞的代谢和命运,因此具有重要的生物学意义。Nature Cell Biology同时上线了一篇News & Views重点推荐该研究论文。
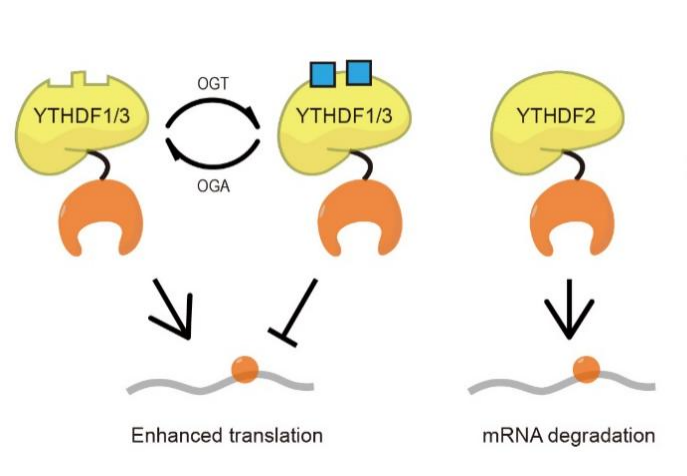
图1、本论文提出的YTHDF家族的三个蛋白调控m6A功能的新机制模型
N6-methyladenosine (m⁶A) 是mRNA上最丰富的转录后修饰,并在生理和病理过程中扮演着重要作用。研究表明,m6A的读码蛋白(reader proteins)决定了带有m6A修饰mRNA的命运。然而m6A生物学的关键基础即YTHDF蛋白的功能机制仍不明确。
我院林世贤课题组长期关注蛋白质翻译后修饰化学计量比例与生物学功能之间的联系。本项目中他们率先提出通过定量检测YTHDF蛋白质的翻译后修饰以阐释YTHDF蛋白的功能机制。研究发现仅在YTHDF1/3蛋白(而非YTHDF2蛋白)上鉴定到高丰度的O-GlcNAc糖基化修饰。且在不同的细胞系、细胞周期以及细胞环境下,糖基化修饰的丰度存在着可逆地动态变化。通过与何川教授合作开展机制研究,发现高丰度的O-GlcNAc修饰干扰YTHDF1/3蛋白对翻译促进因子的招募,进而抑制其对m6A-RNA的翻译促进功能。而当O-GlcNAc修饰处于低丰度水平时,YTHDF1/3蛋白则能高效招募翻译促进因子,加速m6A-RNA的翻译。与葛韵研究员合作利用体内外的相变实验发现O-GlcNAc糖基化修饰是调控YTHDF1/3相分离的组装、动态过程和解聚。因此YTHDF1/3的高丰度O-GlcNAc修饰提高了其在相分离成分中的动态性,加速解聚相分离;而YTHDF1/3的低丰度O-GlcNAc修饰维持了其在相分离组分中的稳定性。这一机制保障了细胞更好的从应激状态中恢复,并调控了m6A-RNA在相分离体系中的动态转运。(图2)这项研究将定量检测技术应用于YTHDF蛋白翻译后修饰水平的分析,验证了YTHDF1/3蛋白对m6A-RNA的翻译促进功能,阐释了O-GlcNAc修饰可逆调控YTHDF1/3蛋白的新机制,发现了YTHDF糖基化修饰调节相分离性质的规律,为YTHDF家族蛋白的功能提供了更为完善的新机制。
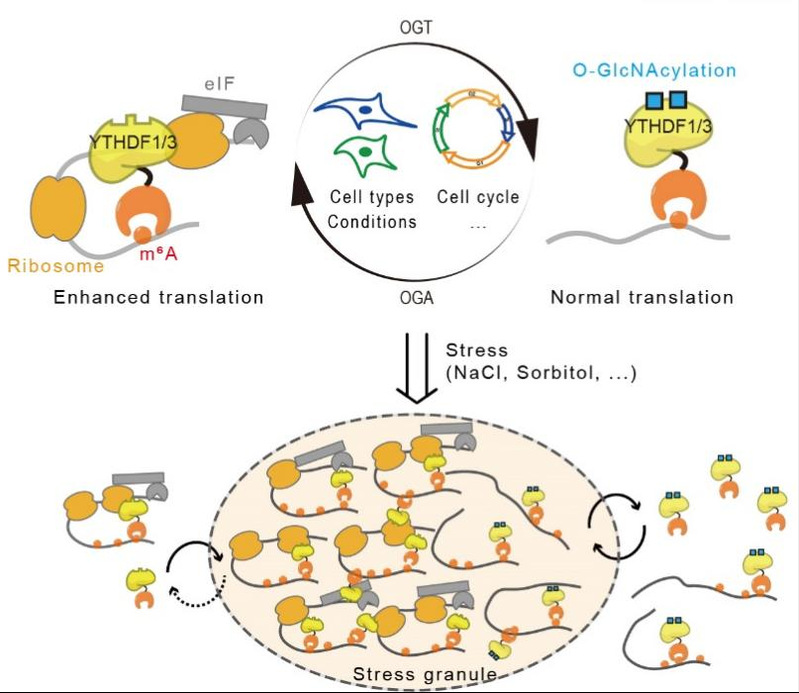
图2、O-GlcNAc修饰可逆调控YTHDF蛋白的翻译促进功能与相分离性质
我院博士后陈宇霖、博士生万芮希及芝加哥大学的邹钟毓为本文的共同第一作者。林世贤研究员、何川教授和葛韵研究员为本研究的通讯作者。研究工作得到了何向伟教授及其生命科学研究院共享技术平台的大力支持与帮助。该研究受国家重大研究计划“生物大分子动态修饰与化学干预”项目,国家重点研发计划“合成生物学”项目等资助。
原文链接:https://www.nature.com/articles/s41556-023-01258-X
林世贤实验室聚焦于中心法则的翻译过程,整合交叉学科的研究手段,探索tRNA和蛋白质修饰的生物学功能和工程改造,并致力于开发新型生物医药,用于重大疾病和罕见遗传病的诊疗。欢迎感兴趣的博士后和研究生联系并申请加入。实验室链接:/25713/list.htm