当营养环境发生变化时,细胞代谢会随之改变,而这一过程所产生的精准代谢信号可以帮助细胞及时地适应新环境。例如,乙酰辅酶A可以作为代谢信号反映生长所需碳源充足,促进邻近生长基因的组蛋白乙酰化,提高基因表达,进而加快细胞分裂生长[1]。因为需要代谢中间产物作为底物,所以组蛋白上对营养环境敏感的修饰变化可以传递代谢信号,从而调节基因表达。近年来越来越多的研究发现,组蛋白或其修饰发生的生化反应本身可以直接参与并影响关键代谢反应[2],例如还原金属铜离子[3]、储存乙酰基团[4, 5]、消耗腺苷甲硫氨酸[6, 7]等。这说明组蛋白可以作为细胞核内的代谢中枢,而这个重要功能却长期被忽视。
2022年4月12日,我院叶存奇实验室在Cell Reports上发表了题为Reciprocal regulation of phosphatidylcholine synthesis and H3K36 methylation programs metabolic adaptation的研究论文。叶存奇博士在德州大学西南医学中心与HHMI研究员Benjamin P.Tu首次提出磷脂与组蛋白甲基化代谢“黑洞”理论(the methyl group sink)[2],回国建立实验室后继续探索这一现象。该研究发现营养缺乏条件下,膜磷脂代谢在改变细胞膜物理特性的同时,消耗大量的腺苷甲硫氨酸,发出饥饿信号,促使组蛋白H3K36发生去甲基化和再甲基化。这一组蛋白甲基化的动态变化在适应饥饿环境中具有关键作用。如果组蛋白H3K36甲基化受阻,细胞将出现严重的饥饿不耐受,并随之出现磷脂代谢失衡、膜流动性异常增加及功能受损、嘌呤嘧啶代谢紊乱等现象。
该研究进一步发现组蛋白可以推动饥饿条件下新生成的腺苷甲硫氨酸向谷胱甘肽合成,验证了组蛋白对甲基的“黑洞”吸收能力,提出组蛋白甲基化是保障细胞核还原环境的一道防线。该项研究还证明了一条嘧啶核苷酸参与的磷脂合成通路对氧化还原环境极其敏感。组蛋白甲基化受阻会破坏磷脂代谢,造成嘧啶代谢中间产物发生错误堆积,阻滞嘧啶回收,使得细胞无法适应饥饿条件。有意思的是,重塑磷脂代谢可以调整膜磷脂成分,驱动核苷酸合成代谢流,提高抗氧化剂谷胱甘肽水平,从而显著改善细胞对饥饿环境的适应性。
综上所述,该研究在真核酵母模型中阐明了磷脂合成是如何通过小分子代谢物与组蛋白修饰发生一个环路信息交换来重塑饥饿条件下的代谢规律。
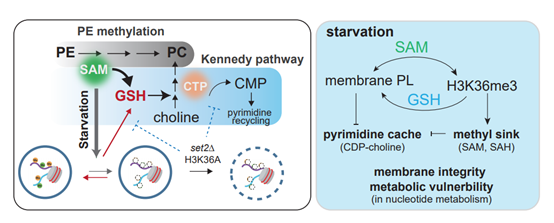
图1:在细胞适应饥饿环境的过程中,磷脂酰胆碱PC合成和组蛋白H3K36甲基化
在氧化还原平衡和核苷酸代谢中的功能调控。
威廉(中国)叶存奇研究员为通讯作者。威廉(中国)博士生方雯、朱羿冰为论文的共同第一作者,博士生杨森和技术员仝小孟对本文做出重要贡献。
原文链接:https://doi.org/10.1016/j.celrep.2022.110672
参考文献:
1.Cai L, Sutter BM, Li B and Tu BP (2011) Acetyl-CoA induces cell growth and proliferation by promoting the acetylation of histones at growth genes. Mol Cell 42:426-37. doi: 10.1016/j.molcel.2011.05.004
2.Ye C and Tu BP (2018) Sink into the Epigenome: Histones as Repositories That Influence Cellular Metabolism. Trends Endocrinol Metab 29:626-637. doi: 10.1016/j.tem.2018.06.002
3.Attar N, Campos OA, Vogelauer M, Cheng C, Xue Y, Schmollinger S, Salwinski L, Mallipeddi NV, Boone BA, Yen L, Yang S, Zikovich S, Dardine J, Carey MF, Merchant SS and Kurdistani SK (2020) The histone H3-H4 tetramer is a copper reductase enzyme. Science 369:59-64. doi: 10.1126/science.aba8740
4.Hsieh WC, Sutter BM, Ruess H, Barnes SD, Malladi VS and Tu BP (2022) Glucose starvation induces a switch in the histone acetylome for activation of gluconeogenic and fat metabolism genes. Mol Cell 82:60-74.e5. doi: 10.1016/j.molcel.2021.12.015
5.Mendoza M, Egervari G, Sidoli S, Donahue G, Alexander DC, Sen P, Garcia BA and Berger SL (2022) Enzymatic transfer of acetate on histones from lysine reservoir sites to lysine activating sites. Sci Adv 8:eabj5688. doi: 10.1126/sciadv.abj5688
6.Ye C, Sutter BM, Wang Y, Kuang Z and Tu BP (2017) A Metabolic Function for Phospholipid and Histone Methylation. Mol Cell 66:180-193 e8. doi: 10.1016/j.molcel.2017.02.026
7.Ye C, Sutter BM, Wang Y, Kuang Z, Zhao X, Yu Y and Tu BP (2019) Demethylation of the Protein Phosphatase PP2A Promotes Demethylation of Histones to Enable Their Function as a Methyl Group Sink. Mol Cell 73:1115-1126.e6. doi: 10.1016/j.molcel.2019.01.012