2022年4月7日,我院陆华松实验室与美国加州大学伯克利分校周强教授团队合作在Nature Cell Biology在线发表了题为“Poly(ADP-ribosylation) of P-TEFb by PARP1 disrupts phase separation to inhibit global transcription upon DNA damage”的研究论文。该工作首次提出了PARP1-P-TEFb信号轴通过相分离动态调控转录延伸活性,介导DNA损伤压力下转录沉默的重要调控功能和分子机理。我院博士研究生付欢怡、贾子瑄和厦门大学刘荣雕博士是该论文的共同第一作者。陆华松研究员、高祥副教授和周强教授是本文的共同通讯作者。
真核细胞中的DNA损伤压力会触发Pol II介导的基因转录暂停,以避免错误转录本的合成,维持基因组稳定性。DNA损伤胁迫介导的转录应答机制十分复杂。例如,UV照射诱导的CPD (Cyclobutane pyrimidine dimers)等光毒性损伤会激活转录偶联核苷酸切除修复(Transcription-coupled nucleotide excision repair, TC-NER) ,以消除转录阻碍并恢复转录活性。其它类型的DNA损伤,如DNA烷基化、氧化、断裂等,也会引起整体转录沉默。尽管已有研究报道多种调控模式,如ATM、DNA-PK、染色质重塑等参与了基因毒性胁迫下的转录抑制,但DNA损伤诱导Pol II阻滞的初始信号以及背后的分子机制仍有待揭示。
PARP1是一种多聚ADP-核糖聚合酶,它能以NAD+为供体,将ADP-ribose转移至底物上,形成共价的聚二磷酸腺苷核糖基化修饰(Poly-ADP-ribosylation, PARylation)。PARP1及其介导的PARylation修饰广泛参与如DNA损伤修复、细胞分化、免疫响应等生物学过程。在DNA损伤应答过程中,PARP1扮演着损伤“探测器”的重要角色。当细胞发生DNA损伤时,PARP1会被迅速招募至损伤部位并激活,通过自修饰形成的PAR链招募并修饰其它响应因子,激活下游信号通路。值得注意的是,DNA损伤应答过程中的PARP1活性及PAR链具有高度的动态性和不稳定性,这一特性阻碍了研究者对于PARP1工作机制的深入理解。
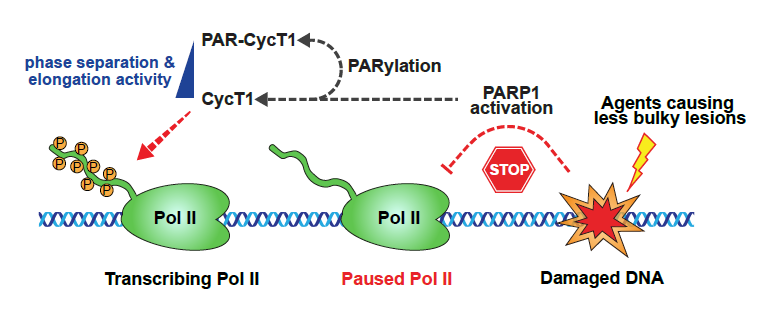
图1:PARP1诱导CycT1发生PARylation修饰并介导DNA损伤后的转录沉默
在本论文中,研究人员首先纯化并鉴定了PARP1在激活前后的蛋白相互作用组,出乎意料地发现转录延伸激酶复合物P-TEFb与PARP1的相互作用在后者活化后显著增强。P-TEFb复合物由CDK9激酶与CycT1亚基构成,是细胞内调控Pol II 从启动子近端停滞状态转变为高效延伸的核心因子。另一方面,DNA损伤能够快速诱导基因转录阻滞,但机制尚不明确。鉴于上述现象,研究人员决定对PARP1与P-TEFb之间的分子作用机制及功能联系做深入研究。通过细胞和体外实验,研究人员证实了在不同的DNA损伤条件下(如双氧水,烷基化损伤剂MNNG,IR辐射等),PARP1可以通过自修饰的PAR链直接招募CycT1至损伤位点并对其进行PARylation修饰。接下来,研究人员构建了不同长度的CycT1截短体来搜寻介导修饰的关键结构域。有意思的是,作者发现驱动CycT1发生液-液相分离的组氨酸富集结构域(Histidine-rich domain,HRD)对其发生PARylation修饰同样重要,提示CycT1的相分离调控与PARylation修饰存在联系。同时,作者建立了一套优化的质谱方案对CycT1发生PARylation修饰的具体位点进行了鉴定。通过突变体回补实验,结合荧光成像、激酶反应及新生转录组测序分析,作者发现DNA损伤后PARP1催化的CycT1 PARylation修饰能够快速解离转录延伸凝聚体,从而抑制了相分离凝聚体中P-TEFb对Pol II CTD的高效磷酸化修饰,造成转录延伸阻滞和基因表达沉默。最后,研究人员利用细胞模型进行了功能上的探索,发现PARP1-CycT1之间的相互作用以及修饰信号可以明显促进细胞在基因毒性胁迫下的DNA损伤修复效率,降低细胞对DNA损伤刺激的敏感性,提高细胞存活率。
综上,该工作聚焦于DNA损伤后PARP1-CycT1信号轴介导的转录应答及相分离调控的重要功能,不仅加深了我们对生物大分子凝聚体动态调控机制的理解,更为靶向DNA损伤修复通路的癌症治疗提供了潜在的靶点。该研究获得了国家自然科学基金面上项目,国家重大研究计划培育项目和浙江省杰出青年基金等项目的资助。陆华松实验室常年招收具有分子与细胞生物学研究背景的研究生与博士后,欢迎对基因转录调控与无膜凝聚体功能研究感兴趣的同学加入。
原文链接:https://www.nature.com/articles/s41556-022-00872-5