2022年1月7日,我院姬峻芳教授实验室于《Gut》在线发表题为“Blocking Hepatocarcinogenesis by A Cytochrome P450 Family Member with Female preferential expression”的研究论文。该研究揭示CYP39A1为肝脏特异女性高表达基因,具有阻断肝细胞癌发生发展的作用,该功能与其显著抑制c-Myc活性紧密相关。
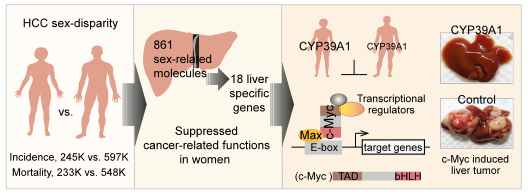
图1:肝脏特异性别差异基因CYP39A1阻断c-Myc诱导肝癌。
全世界范围内,肝细胞癌在男性中的发病率是女性的2 ~ 5倍。深入解析肝细胞癌性别异质性的机制,或可找到在女性中生理存在的、关键肝细胞癌抑制机制,造福广大肝细胞癌患者群体。
由此,姬峻芳实验室深入研究了肝细胞癌的多种组学数据,发现861个在两性肝脏中存在显著差异的分子,这些分子在女性肝脏中的表达模式与多种肿瘤相关疾病与功能的抑制紧密关联,为肝细胞癌在女性中发生率显著低于男性的关键分子生物学基础。
在这些性别差异分子中,细胞色素P450家族成员CYP39A1为常染色体定位的肝脏特异表达基因,其在女性肝脏中的表达明显高于男性肝脏,而且在>93% 肝细胞癌患者中表达明显沉默。在小鼠原位肿瘤实验中CYP39A1可以显著抑制肝细胞癌的发生和发展,此作用不依赖该基因的已知细胞色素P450酶代谢功能,而是通过影响c-Myc与其功能调节蛋白的相互作用,抑制了c-Myc转录因子的转录激活活性,从而阻断肝细胞癌的发生与发展。另外,在多种小鼠原位肝细胞癌模型实验中,CYP39A1在显著抑制肿瘤发生和发展的同时,并未改变小鼠的性激素水平,也未造成任何小鼠两性性征的改变。
该研究揭示了一组肝细胞癌性别异质性相关的基因,并深入解析了女性肝脏高表达基因CYP39A1在抑制肝癌发生发展中的角色,提示对CYP39A1进行调控或可助益于精准治疗肝癌和高危人群的肝癌预防。
姬峻芳实验室博士后姬付博是本文第一作者,姬峻芳教授为本文的通讯作者,威廉(中国)为论文第一单位。该工作获得国家自然科学基金、国家重点研发计划等经费的资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/34996827/