2021年11月18日,我院沈立课题组在Nucleic Acids Research杂志上在线发表了题为“Relaxed 3D genome conformation facilitates the pluripotent to totipotent-like state transition in embryonic stem cells”的研究论文,通过三维基因组测序等一系列表观基因组学研究,揭示了染色质高级结构在多能性胚胎干细胞向全能样干细胞转变过程中的动态变化和调控功能。
干细胞研究是生命科学领域的热点和前沿,也是细胞治疗与再生医学的重要基础,对推动医学进步和人类健康有着深远的意义。具有最高分化潜能的干细胞被称为全能性干细胞,这类细胞具有发育形成完整个体的分化潜能——既可以分化成所有胚胎内组织,又可以分化为胎盘、卵黄囊等胚外组织。全能性干细胞通常指受精卵和早期的卵裂球,如小鼠胚胎二细胞期卵裂球。而小鼠胚胎干细胞(ESC),作为在干细胞研究中最为广泛使用的体外细胞模型,几乎只具有分化为胚内组织的能力,因此被称为多能性干细胞。有意思的是,近年来有研究表明体外培养的小鼠胚胎干细胞中也存在约1%的细胞动态地处于全能性状态。这些获得全能性的胚胎干细胞不表达Sox2、Nanog等多能性相关基因,却高表达一系列二细胞胚胎(2C)特异性的基因和重复序列(如Dux、Zscan4基因簇和内源性逆转录病毒MERVL等),并且在嵌合体实验中可以分化为胚内和胚外组织,因此被称为二细胞样细胞(2-cell-embryo-like cells, 2CLC)。目前,虽然维持胚胎干细胞多能性的分子调控网络已经比较清楚,但是多能性胚胎干细胞怎样获得全能性以及这种发育全能性的分子机制尚不明确。
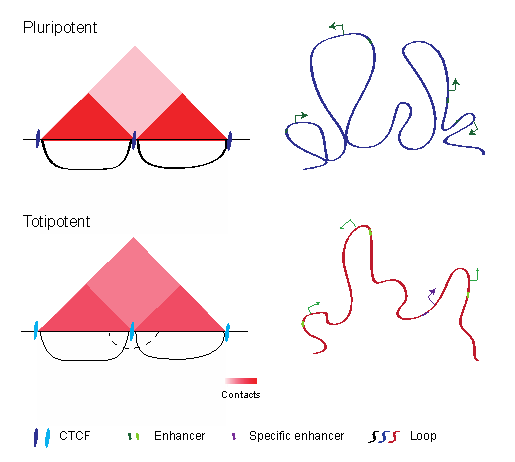
细胞命运的改变本质上是其表观遗传信息的多层次重编程。为了探究胚胎干细胞获得全能性的分子调控机制,研究团队利用胚胎干细胞由多能性向全能性转变(即2C样转变)作为体外研究模型,采用一系列微量细胞表观基因组测序技术,绘制了2C样转变前后的全基因组染色质三维构象图谱、染色质可及性图谱以及多种组蛋白修饰图谱。通过对这些数据的整合分析,作者揭示了2C样转变过程中染色质状态和基因表达的动态变化,发现胚胎干细胞的染色质高级结构在转变过程中变得更加松散——A/B 区室(A/B compartment)、拓扑关联结构域(TAD)和染色质环都呈现出全基因组水平的整体性减弱。其中增强子(尤其是超级增强子)与基因启动子之间染色质环的减弱可能降低了胚胎干细胞特异增强子的活性,并进而引起它们所调控的多能基因(如Oct4、Sox2和Nanog)的转录下调,促使细胞退出多能性状态。同时,论文作者还发现胚胎干细胞在2C样转变过程中形成了许多与DUX结合相关、富集组蛋白H3K27Ac修饰的2C特异性增强子,并且上调基因的启动子附近在胚胎干细胞中往往存在TAD边界将它们与相邻的2C特异性增强子分隔开。2C样转变过程中TAD边界环的减弱导致TAD绝缘性的降低,因此可能有利于胚胎干细胞中偶发激活的2C特异性增强子与附近2C基因启动子之间的接触,从而促进它们的表达,进而完全激活2C样转录程序。为了进一步证明松散的染色质结构可以促进全能性的获得,论文作者还利用生长素诱导的degron系统在胚胎干细胞中诱导了染色质架构蛋白CTCF的快速降解。CTCF的急性降解不仅破坏了细胞中的染色质环,而且显著地促进了胚胎干细胞从多能性向全能性的转变。类似的,作者在敲减介导TAD形成的关键蛋白质复合物cohesin后也观察到了类似的现象。综上所述,该研究阐明了染色质高级结构在全能性的获得和调控中具有关键的作用,也为充分理解全能性的分子机制提供了丰富的表观基因组数据集。
该研究受到了国家自然科学基金面上项目、优秀青年科学基金,国家科技部重点研发计划,浙江省杰出青年科学基金等项目的资助。威廉(中国)博士研究生朱业张、俞佳丽和顾佳慧同学为本文的共同第一作者。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab1069/6430492?searchresult=1