雌性哺乳动物在出生以后,卵母细胞的细胞周期停滞在减数第一次分裂前期,直到排卵前夕才在促性腺激素的刺激下恢复减数分裂,经不对称分裂排出极体,等待受精。卵母细胞的减数分裂成熟是受精成功的关键,也常常是辅助生殖治疗中的卡脖子问题。异常的染色体分离会导致胚胎非整倍性,造成早期流产或后代遗传疾病。
哺乳动物卵母细胞发育的一个关键特征是,在生长到合适体积以后,基因组转录活动停止,此后的减数分裂成熟、受精和母源-合子过渡过程几乎完全由已存在于卵母细胞中的母源mRNA和蛋白分子调控完成。二十多年前科学家们就发现,丝裂原活化蛋白激酶(MAPK)级联通路伴随卵母细胞减数分裂发生激活,并且对于纺锤体的正常组装、迁移、染色体精确排列,以及卵母细胞不对称分裂,都是必需的。但该通路发挥上述作用的直接生化机制,一直没有被充分阐明。
威廉(中国)范衡宇教授实验室近年来的系列工作揭示,MAPK级联通路的两个关键蛋白激酶ERK1/2,主要是通过促进卵胞质中储存的母源mRNA发生翻译激活,从而整合了大量参与减数分裂的蛋白分子,推动细胞周期进程。胞质中mRNA发生翻译激活的关键一步是poly(A)尾的延长,进而招募翻译启始因子。但到目前为止,在哺乳动物卵母细胞中催化mRNA加polyA尾的腺苷酸聚合酶(poly(A) polymerase,PAP)一直没有被确认,更不清楚它是否直接受到ERK1/2的调控。
在本研究中,该团队首先证实,在小鼠基因组所编码的多个PAP中,PAPα在卵母细胞中表达水平最高,并且在生发泡(卵母细胞的细胞核)和卵胞质中均有分布。在小鼠卵母细胞中抑制PAPα活性,会阻断关键母源mRNA加poly(A)尾,使其不能发生翻译激活,造成减数分裂缺陷;而过表达PAPα,则会诱导卵母细胞提前启动减数分裂成熟过程。研究团队还发现,PAPα蛋白在减数分裂成熟过程中,有三个丝氨酸残基发生了磷酸化;与减数分裂密切相关的ERK1/2和CDK1是催化这些位点发生磷酸化的蛋白激酶;磷酸化修饰后的PAPα,与调控mRNA加尾的多亚基蛋白复合体CPSF(cleavage and polyadenylation-specific factor)结合更加紧密,因此具有更高的催化活性。此外,研究团队通过分析PAPα的表达模式发现,PAPα蛋白水平在卵母细胞成熟过程中不断增加,因为编码PAPα蛋白的mRNA 3’-UTR中也具有多个翻译调控元件,包括CPSF的结合元件,能够在PAPα催化下发生poly(A)尾的延长,伴随减数分裂恢复而发生翻译激活。
综合本研究的结果,PAPα在卵母细胞恢复减数分裂时,经三重正反馈激活,促进母源mRNA加poly(A)尾:(1)卵母细胞启动减数分裂成熟以后,生发泡破裂,原本贮存在生发泡中的PAPα蛋白分子被释放到卵胞质中,直接催化胞质中的mRNA加poly(A)尾;(2)CDK1和ERK1/2催化PAPα磷酸化激活,从而把胞质mRNA加poly(A)尾与减数分裂细胞周期进程偶联起来;(3)激活后的PAPα也通过正反馈机制,催化编码自己的mRNA发生poly(A)尾延长和翻译激活,从而以滚雪球的方式迅速增加PAPα在卵胞质中的表达量,促进减数分裂的不可逆进行。
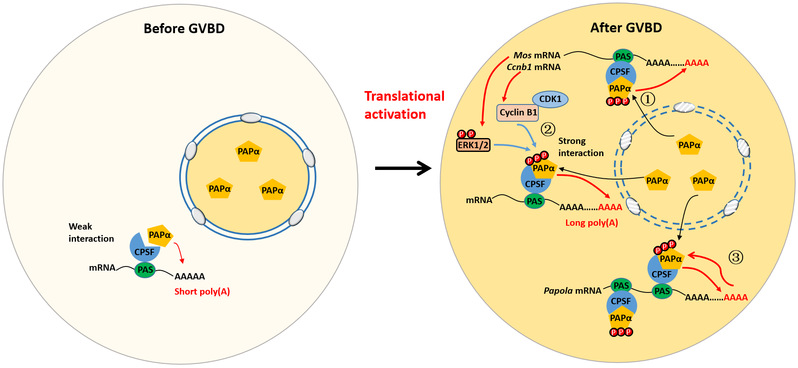
图1:卵母细胞减数分裂成熟过程中的PAPα正反馈激活机制
该研究工作的主要创新性意义在于:(1)找到了直接催化哺乳动物母源mRNA发生poly(A)尾延伸的酶;(2)发现PAPα是ERK1/2在卵母细胞中的直接磷酸化底物,进一步揭示了MAPK级联通路调控卵母细胞减数分裂的生化机制;(3)虽然本研究主要以小鼠卵母细胞为研究对象,但胞质mRNA加尾过程也普遍存在于多种细胞类型(如神经细胞、血细胞),因此PAPα的多重调控机制很可能在体内众多生物学事件中具有广普意义。
相关研究论文近日在线发表在Nucleic Acids Research上,威廉(中国)博士研究生江俊超同学为该论文第一作者,范衡宇教授为通讯作者。研究生张华、曹兰蕊、赵龙雯和博士后戴兴兴也参与了这一工作,山东大学刘洪彬教授为本研究提供了抗体制备的帮助。该研究受到国家自然科学基金,浙江省重点研发计划,国家重点研发计划等项目的资助。