2021年3月24日,浙江大学医学院附属邵逸夫医院蔡秀军教授团队与郭行教授团队合作,于Science Advances发表题为“A tumor-suppressive circular RNA mediates uncanonical integrin degradation by the proteasome in liver cancer”的研究长文,首次报道一种新型环状RNA通过直接介导整合素β1经26S蛋白酶体降解进而抑制肝癌转移的全新机制。该文被期刊编辑部选为rotate highlight图片重点推荐。
图1 Science Advances 网站上rotate highlight图片
肝细胞肝癌是原发性肝癌中最为常见的类型,在全球范围内,肝癌发病率位于恶性肿瘤的第六位,致死率则位于第三位。尽管目前已有多种分子靶向药物应用于肝癌的治疗,但肝癌患者的5年生存率仅为12.1%。相较于其他恶性肿瘤,肝癌易早期复发转移是其预后不佳的主要原因之一。
本研究鉴定出一种在肝癌组织中显著低表达的新型环状RNA——circPABPC1,且预后分析显示circPABPC1水平与肝癌患者的生存率呈正相关。circPABPC1可通过干扰肝癌细胞的黏附能力,显著抑制肝癌进展,特别是抑制早期的肝内转移。研究人员鉴定出整合素β1(ITGβ1)是circPABPC1的下游主要效应蛋白。进一步的研究结果表明,circPABPC1可以作为蛋白间的支架(protein scaffold)直接促进ITGβ1经蛋白酶体降解,这与经典理论认为膜蛋白主要通过溶酶体代谢循环不同,是一种全新的膜蛋白降解模式。
随着近年来在RNA递送技术和RNA体外合成修饰技术的进步,越来越多研究提示具有高稳定性和易递送性特点的circRNA有望成为新型药物。本文研究结果显示,circPABPC1发挥功能的形式与蛋白降解靶向嵌合体(PROTACs)技术具有共通性。通过适当的突变改造,circRNA具备靶向降解其他膜蛋白的潜能。
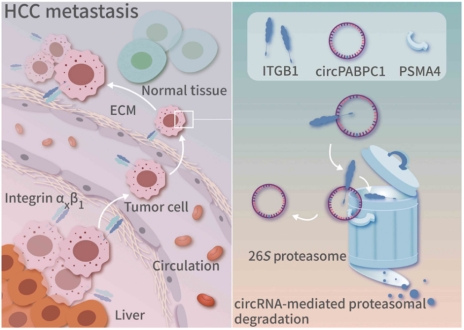
图2 机制阐述
蔡秀军教授、郭行教授和王一帆教授为本文的共同通讯作者。该研究得到医学院张岩教授及电镜平台的大力帮助,受到国家重大科研项目、国家自然科学基金项目、浙江省重点研发计划、中国博士后科学基金项目等资助。
原文链接:https://advances.sciencemag.org/content/7/13/eabe5043