2020年11月30日,我院姬峻芳教授实验室在Journal of Experimental & Clinical Cancer Research杂志在线发表题为“Loss of miR-192-5p initiates a hyperglycolysis and stemness positive feedback in hepatocellular carcinoma”的研究文章。该文章讲述肝脏特异性miR-192-5p调控肝细胞癌肿瘤细胞自身代谢、且进而影响周围非肿瘤细胞信号转导通路,协同抑制肝细胞癌的肿瘤干性特征。该研究是对2018年姬峻芳实验室在Cancer Research杂志在线发表题为“miR-192-5p silencing by genetic aberrations is a key event in hepatocellular carcinomas with cancer stem cell features”课题的延续工作。
肝细胞癌(HCC)中已发现多个肿瘤干细胞(CSC)标志物,对其细胞表型及相关信号调节机制亦有了较为深入的了解。然而,这些CSC阳性细胞的相关代谢表征及相关调节机制仍然未知。在肝脏中,miR-192-5p表达丰度高且在多种CSC标记阳性的HCC病人肿瘤样本中表达沉默。因此,我们通过研究miR-192-5p缺失的HCC组织和细胞,以期了解多类不同CSC阳性的HCC之间共有的关键代谢特征。
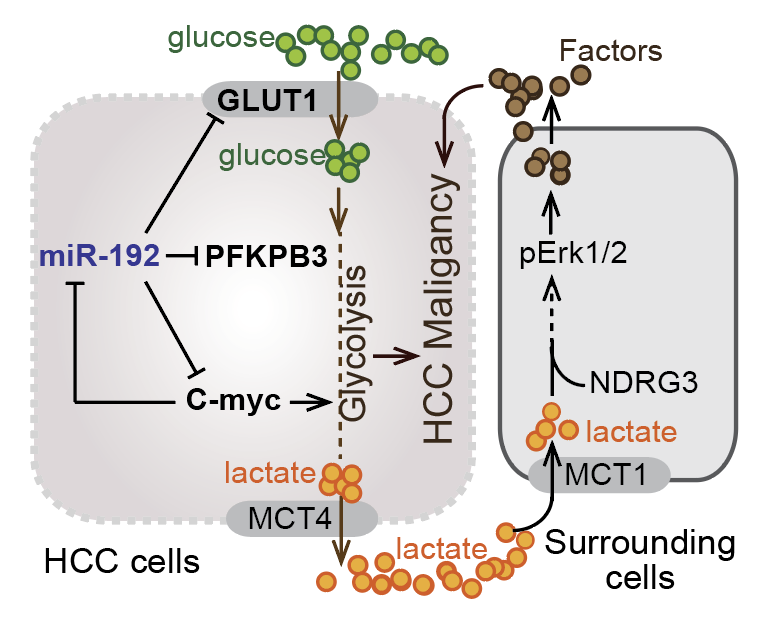
图一:在肝细胞癌中,miR-192-5p抑制糖酵解和肿瘤干性特征。
在两个独立的HCC患者队列中,我们发现miR-192-5p低表达组和多组CSC阳性表达组中,糖酵解相关代谢物和基因均呈现显著高水平表达。构建的miR-192-5p敲除细胞则呈现增强的肿瘤干性和糖酵解。机制研究发现, miR-192-5p的缺失通过上调GLUT1和PFKFB3(两种糖酵解酶)和c-Myc(调节糖酵解基因的表达)增强糖酵解水平。同时,c-Myc可以抑制miR-192-5p的转录表达,从而确保了低miR-192-5p /高c-Myc轴来维持HCC细胞持续增强的糖酵解水平。此外,高糖酵解的HCC细胞产生过量的乳酸,部分通过NDRG3和MCT1激活了共培养的LX2(人源肝星状细胞系)和THP1(人源单核细胞系)的ERK磷酸化,进而促进了HCC细胞的肿瘤干性。该现象与HCC病人临床特征一致,即:肿瘤组织中miR-192-5p表达水平低,而非肿瘤组织中NDRG3或MCT1水平高的HCC患者,其总生存期最短。
这项工作为理解肝癌的肿瘤干细胞异质性和肿瘤代谢提供了新的理论与实验依据,也进一步揭示了肝脏特异性miR-192-5p如何在HCC发生发展过程中扮演重要角色。
姬峻芳实验室博士研究生顾元卓和姬付博是本文共同第一作者,姬峻芳教授为本文的通讯作者,威廉(中国)为论文第一作者单位。该工作获得国家自然科学基金(No. 81672905、81874054和82073055)、中国国家重点R&D计划(2018YFA0800504)等经费的资助。
原文链接:https://jeccr.biomedcentral.com/articles/10.1186/s13046-020-01785-7#Fun