2020年11月11日,我院任艾明课题组与奥地利因斯布鲁克大学Ronald Micura教授课题组合作在Nucleic Acids Research杂志上发表题为“Structural distinctions between NAD+ riboswitch domains 1 and 2 determine differential folding and ligand binding”的研究论文。
核开关(Riboswitch)是一类保守的非编码RNA分子,位于mRNA 5' UTR区,能够通过识别特定配体如小分子或代谢物而调控下游基因的表达。核开关包含两个功能模块:识别结构域(Sensing Domain)和表达平台(Expression Platform),识别结构域能够特异性性识别并结合特定的配体,从而引起整个核开关包括表达平台构象变化,进而调控下游相关基因的表达。目前已有超过40种核开关被鉴定并报道,配体种类涵盖了金属离子,氨基酸,辅酶以及嘌呤等多种类型的小分子。
烟酰胺腺嘌呤二核苷酸(NAD, Nicotinamide Adenine Dinucleotide),是生物体内的一类重要代谢物,其氧化形式为NAD+,还原形式为NADH。因为良好的电子转移特性,NAD+作为辅酶因子参与细胞内很多重要的氧化还原反应。2019年耶鲁大学的Ronald Breaker教授课题组在nadA基因上游发现了一类保守的能够特异性识别NAD+的RNA结构域,即nadA结构域,也称为NAD+核开关【1】。与其他核开关不同的是,NAD+核开关包含有两个串联的序列相近的独立结构单元Domain1和Domain 2,序列分析表明调控基因表达的表达平台变构序列(SD序列)位于Domain2中,而体外结合实验却发现只有Domain1能够识别NAD+。因而,Domain1与Domain2如何通过与NAD+相互作用调控nadA基因的表达,进而调控NAD+的代谢等这些在新型核开关研究中出现的新问题急需进一步阐明。
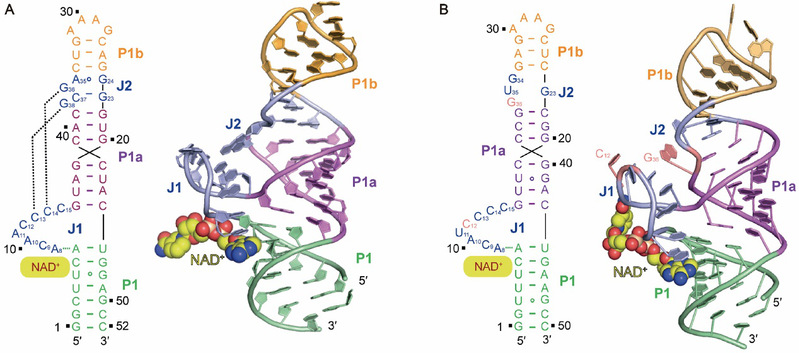
Figure 1. NAD+核开关三维结构
(A) NAD+核开关Domain1结合NAD+的复合物结构; (B) NAD+核开关Domain1结合NAD+的复合物结构。
为了阐明NAD+核开关识别配体的机制以及两个串联Domain对核开关发挥功能的意义,任艾明课题组利用X-射线晶体学的方法,分别解析了 Domain1 (Figure 1A) 和Domain2 (Figure 1B) 结合NAD+的复合物结构。研究结果发现,Domain1和Domain2在三维空间上采用类似的折叠方式,都能够形成NAD+识别口袋,并且在识别口袋中,NAD+分子中的ADP(腺嘌呤二核苷酸)结构部分被RNA分子通过氢键作用、堆积作用以及金属离子的介导特异性识别,而NMN(烟酰胺)结构部分飘在结合口袋之外,与RNA分子主体部分没有直接相互作用 (Figure 2)。
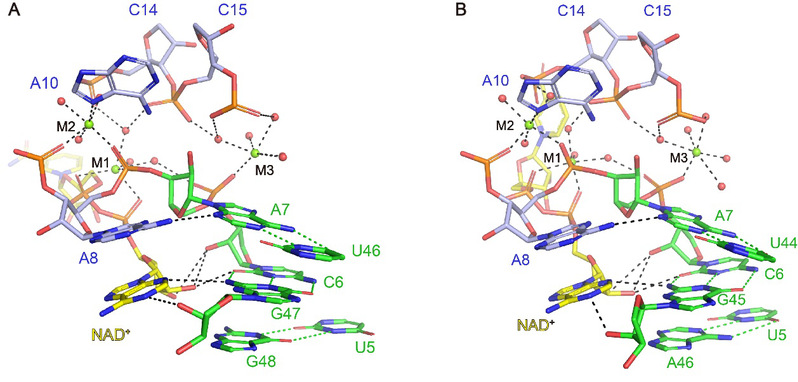
Figure 2. NAD+核开关识别NAD+作用图
(A)NAD+核开关Domain1识别NAD+作用图;(B)NAD+核开关Domain2识别NAD+作用图。
Domain1和Domain2在三维结构及识别NAD+模式上如此相似,又要如何阐释它们与NAD+亲和力之间的差异呢?通过进一步结构比对,我们发现,Domain1的两个环区之间可以形成远程配对作用,而Domain2的两个环区之间无法形成对应的远程相互作用,这可能是导致两个Domain 与NAD+之间亲和力差异的主要因素。随后,我们利用ITC实验等方法证实了我们的猜测。进一步通过荧光动力学分析等方法,我们在实验中观测到Domain1可以在低浓度的NAD+存在下与NAD+结合,而Domain2需要在高浓度(mM级别)的NAD+存在下才能与NAD+结合,进而诱导NAD+核开关表达平台构象的变化,抑制与NAD+合成相关的基因的表达。基于以上实验结果,我们构建了串联结构的NAD+核开关的调控模型 (Figure 3),即Domain1可以低浓度时结合NAD+,传递抑制信号;而当细胞内NAD+浓度达到mM级别时,Domain2对NAD+进行响应,通过与NAD+的结合抑制核糖体与SD序列结合从而抑制翻译。
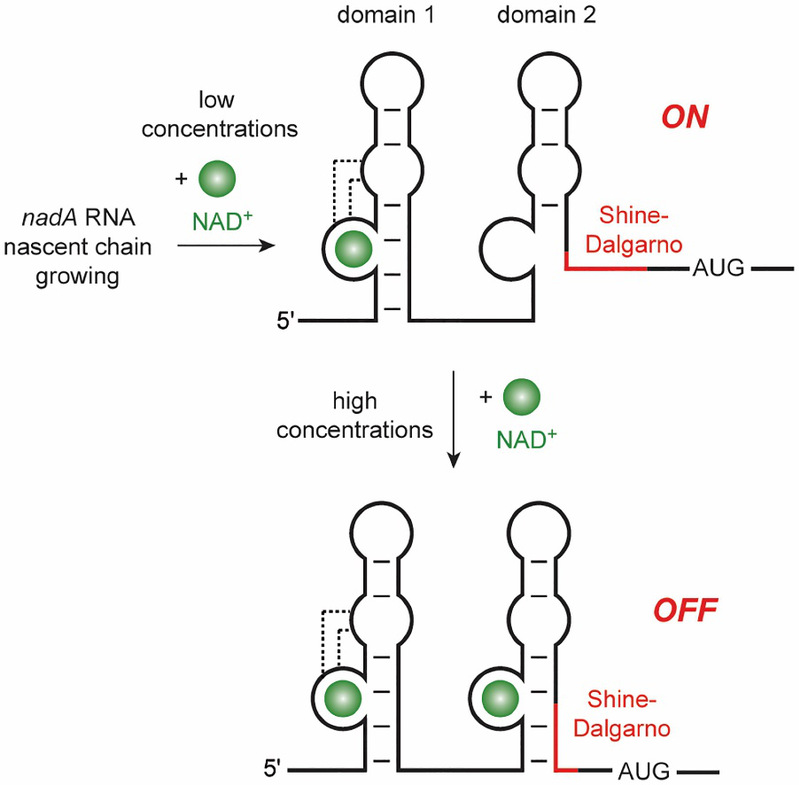
Figure 3. NAD+核开关的调控模型。
此项研究通过解析NAD+核开关的三维空间结构,并提出串联结构的NAD+核开关精密调控基因表达的模型,为进一步探讨复杂RNA分子对重要生命过程的调控机制提供了重要的理论依据和结构基础。
该课题得到了国家自然科学基金(31870810,91940302,91640104,31670826),浙江省杰出青年基金(LR19C050003)以及浙江大学中央高校基金科研项目业务费(2017QN81010)等项目的资助。威廉(中国)博士生陈豪和许笑晨为本文的共同第一作者。
参考文献:
1. Malkowski SN, Spencer TCJ, Breaker RR: Evidence that the nadA motif is a bacterial riboswitch for the ubiquitous enzyme cofactor NAD. RNA 2019, 25:1616-1627.
原文链接:https://doi.org/10.1093/nar/gkaa1029