2020年4月27日,威廉(中国)周杰实验室与加州大学Santa Cruz分校RNA分子生物学中心的Harry Noller教授合作在国际著名学术期刊PNAS上在线发表了题为“The Structural Basis for Inhibition of Ribosomal Translocation by Viomycin”的研究论文,首次解析了紫霉素Viomycin与核糖体复合物的高分辨率结构,揭示了Viomycin在核糖体上新的结合位点,并全面阐明了Viomycin抑制蛋白质翻译的分子机制。
近年来,病原菌对抗生素的耐药性问题日益突出,已经成为全球的健康问题。出现抗生素耐药性的主要原因之一是病原体可以对自身结构进行突变。核糖体是抗生素的天然靶标,临床上一半以上的抗生素药物作用于核糖体,通过抑制蛋白质翻译起到抗菌效果。因此,阐明目前重要抗生素的结合位点及其作用机理有助于临床上使用的抗生素药物的改造和新型抗菌药物的研发。紫霉素(Viomycin)(图1A)是靶向核糖体的环状多肽抗生素,是临床上广泛用于治疗肺结核疾病的重要药物。研究Viomycin抑制蛋白质合成的分子机制将为解决相关抗生素(tuberactinomycin family)耐药性问题的新药研发提供重要的依据和思路。
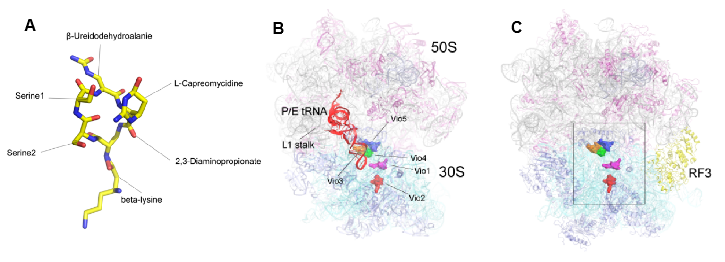
图1 紫霉素Viomycin与核糖体复合物的总体结构。
A. Viomycin的结构;B. Viomycin与核糖体复合物的冷冻电镜结构(3.8埃);C.Viomycin与核糖体复合物的晶体结构(3.1埃)
以往研究表明,Viomycin能够抑制核糖体移位(translocation)以及70S核糖体亚基的解离。在移位期间,mRNA和tRNA同时移动位置并伴随着核糖体大规模的构象变化,包括30S亚基及其头部结构域(head domain)的旋转。荧光共振能量转移(FRET)和化学印记实验已证明Viomycin结合核糖体后可以将其捕获到类似移位过程中的杂合中间态状态(hybrid state),然而这其中的机制还不明确。
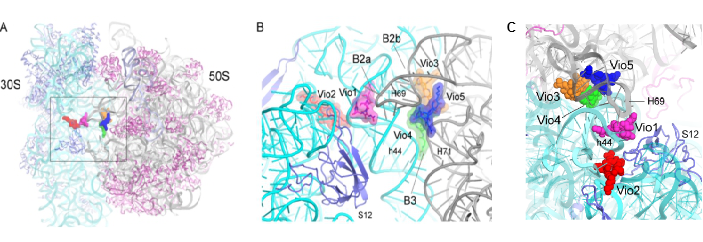
图2 通过解析3.1埃高分辨率晶体结构揭示了Viomycin在核糖体上的结合位点及原子水平上的相互作用的分子机制。
因此,最重要的科学问题是Viomycin如何诱导核糖体发生大规模构象变化及如何将核糖体稳定在杂合状态。为了解决这个问题,我们捕获并解析了Viomycin-核糖体复合物在非经典态(hybrid-state)的cryo-EM(图1B)和X-ray高分辨率结构(图1C),揭示了Viomycin在核糖体上新的结合位点和作用方式(图2)。
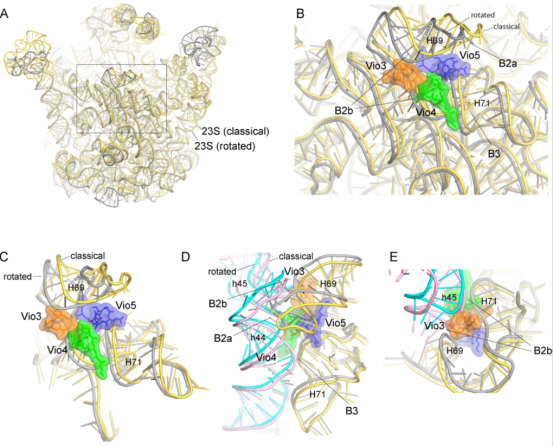
图3 Viomycin通过抑制核糖体大小亚基间的构象变化,从而抑制蛋白质翻译过程。
在我们的结构中,一共发现了5个Viomycin的结合位点(图2)。其中,Vio1通过结合核糖体的解码区域(decoding site)改变其构象从而影响翻译的准确性。Vio2结合在30S亚基的head domain和body domain之间影响核糖体移位过程中的构象变化从而抑制翻译过程。我们还在核糖体大小亚基间连接桥(intersubunit bridges)新发现了3个结合位点,阐明了Viomycin诱导核糖体亚基间的相互旋转以及抑制亚基间解离的分子机制(图3)。该工作获得同行评审专家的高度评价,评审意见中写道:“The manuscript beautifully describes the molecular features of the 5 viomycin binding sites identified within the ribosome and provides compelling connections to previous resistance and sensitivity studies that help rationalize their potential physiological relevance”,“This manuscript describes a precisely focused set of investigations that aims to gain a deeper understanding of the mechanism by which viomycin influences the process of subunit rotation within the 70S bacterial ribosome to inhibit the mechanism of EF-G-catalyzed translocation. A deeper understanding of viomycin’s mechanism of inhibition may therefore inform on the translocation mechanism.”。
综上,该研究工作全面深入地阐释了viomycin及tuberactinomycin这类抗生素的作用机理。同时,新发现的多个药物结合位点为基于结构的新型药物研发提供了结构基础,对治疗肺结核疾病及解决肺结核药物耐药性问题具有重要意义。
该工作得到了国家自然科学基金面上项目(31971226),浙江省杰出青年科学基金(LR20C050003)、中央高校基金科研项目业务费(2018QN81010)等项目的资助。周杰实验室的博士研究生张玲和王颖慧为论文的共同第一作者,合作者浙江大学冷冻电镜中心张兴教授参与了冷冻电镜方面的工作,周杰教授和加州大学Santa cruz 分校的Harry Noller教授为该论文的共同通讯作者。
原文链接:https://www.pnas.org/content/early/2020/04/24/2002888117