Western Blot(蛋白质印迹法)
实验概述:
蛋白质印迹法(免疫印迹试验)即Western Blot,简称WB。它是分子生物学、生物化学和免疫遗传学中常用的一种实验方法。其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息。
实验目的:
获得特定蛋白质在所分析的细胞或组织中的表达情况的信息。
实验原理:
Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
实验步骤:
1. 提取组织或细胞蛋白
1) 提取组织蛋白流程
a) 将PBS置于冰上预冷。
b) 从-80℃冰箱中取出保存的组织放于冰上,用剪刀剪取绿豆粒大小的组织(30mg左右),放入标记好的1.5mlEP管中。
c) 向装有组织的EP管中加入预冷的1X的PBS液体400μl,用剪刀剪碎组织,用小离心机短暂离心,弃上清。
d) 重复步骤3两遍。
e) 在研钵中加入400μl裂解液(1片磷酸酶抑制剂溶解于10ml RIPA,再加入100μl100mM的PMSF),将EP管中的组织转移到研钵中。
f) 加入少量液氮充分研钵组织至匀浆状态。
g) 将匀浆小心转移至1.5mlEP管中,冰上放置20min。
h) 预冷离心机。离心:4℃,12G,20min。
i) 离心后的EP管中的液体分为3层,吸取中间层(目的蛋白)。
2) 提取细胞蛋白流程
a) 对于悬浮细胞,收集对数生长期细胞,消化为单细胞,离心后弃上清液,用4℃预冷的PBS离心洗涤2~3遍,弃上清后将装有细胞的离心管置于冰上;对于贴壁细胞,可将细胞消化下来按照悬浮细胞的操作(也可用预冷的PBS洗涤后(防止培养基中的蛋白干扰),直接加入裂解液后再冰上摇床30min后用细胞刮刀将细胞刮下来)。
b) 加入裂解液(10cm皿加1ml裂解液,六孔板一孔加200μl裂解液),混匀后转移至1.5mlEP管中,并置于冰上裂解30min。
c) 离心机提前预冷,裂解结束,涡旋一下后离心(4℃,12G,15min)。
d) 离心结束后取上清液定量检测蛋白浓度,用PBS稀释到蛋白浓度一致(验证敲减效率、过表达等需要equal loading的实验建议测蛋白浓度),加入5X loading buffer(裂解液:5X loading buffer=4:1),100℃煮样10-20分钟,注意用试管架压防止爆盖子(使蛋白加热变性带上负电荷)。
电泳:带电粒子在电场作用下,向着与其电荷相反的电极移动的现象。Western Blot常用聚丙烯酰胺凝胶电泳(PAGE),具有无电渗作用,样品用量少(1-100μg),分辨率高,凝胶机械强度大(韧性作用好),重复性好以及可以调节单体浓度或单体与交联剂的比例而得到孔径不同的凝胶(根据聚丙烯酰胺的量配成6%,8%,10%,12%,15%的凝胶)等优点。注:不同百分比的凝胶最佳分离蛋白的分子量大小不同,根据蛋白Marker的指示区分不同分子量的蛋白在凝胶上的位置。
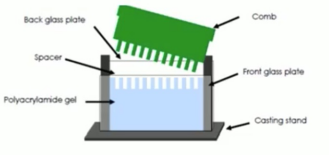
2. 配胶
1) 将长短玻璃板底端对齐,短板冲自己夹在板架上,确定底边对齐,防止漏胶;
2) 配置分离胶即下层胶(注:TEMED最后加);
3) 胶摇匀后灌胶,将分离胶注入玻璃板,加上胶后加水封胶,移动缓慢加水,赶走气泡;
4) 等待胶凝,大约20~30min,等待结束前配置浓缩胶即上层胶;
5) 倒掉水,用滤纸小心吸一下,注意不要碰到胶;
6) 胶摇匀后将浓缩胶注入玻璃板,加满,立即插入梳子(提前洗净擦干),注意不要有气泡,等待胶凝20~30min。
3. 丙烯酰胺凝胶电泳
1) 将玻璃板从板架上撤下放置在电极板上,短板在内测,短板上端卡在电极板的绿色卡口处,红队红,黑对黑放入电泳槽中,倒入电泳缓冲液,先从电极板中间加入,倒满后再倒入槽中。一个电极板时加至2GEL处,两个电极板时加至4GEL处,观察是否漏液,如果漏液就取出重新加,不漏液就垂直向上拔出梳子加样。(预留蛋白Marker的孔位,每孔加3μl左右即可)

2) 一阶段电泳,80V电压大约25-35min使样品跑置分离胶处,目的是把分离胶孔中的样品压缩成一条线。
3) 二阶段电泳,改变电压到120V,至样品跑到底端绿线处,大约1h。
注意点:不同大小分子量的蛋白电泳的时间不同,比如分子量小的目的蛋白无需样品跑到绿线处,只要Marker在该目的蛋白预计分子量处跑开即可。而目的蛋白分子量较大的,可以继续往下跑,让大分子量的蛋白可以分的更开
4. 电转膜仪转膜:Western Blot常用PVDF(聚偏二氟乙烯)膜,具有更好的蛋白吸附、物理强度,以及具有更好的化学兼容性。
 转膜(实验室常用湿转,稳定性较好,实验准备转膜套装(转膜夹子、海绵)、甲醇、滤纸、PVDF膜(使用前甲醇浸泡至透明,甲醇可回收))。
转膜(实验室常用湿转,稳定性较好,实验准备转膜套装(转膜夹子、海绵)、甲醇、滤纸、PVDF膜(使用前甲醇浸泡至透明,甲醇可回收))。
1) 配置1X trans buffer(10X trans buffer 100ml + 甲醇 200ml + ddH2O 700ml);
2) 剪一张比胶更大一点的膜(大约9cm*6cm);
3) 提前准备冰;
4) 用镊子将PVDF膜甲醇浸泡;
5) 剥胶,将玻璃板撬掉,撬的时候动作要轻,玻璃板撬松动后,除去小玻璃板后,将浓缩胶轻轻刮去,要避免把分离胶刮破;
6) 转膜,将转膜夹子放在盛有1X transbuffer的托盘中,黑色朝下(负极),放上专用海绵→滤纸→胶→PVDF膜→滤纸→海绵;依次放入后赶走气泡,夹好转膜夹(转膜的夹子一定要适当紧一点),放入转膜槽(注意正负极,夹子朝上,黑对黑),倒入1X transbuffer,槽内放置冰盒降温,加持恒流电压恒流300mA ,1.5-2h(时间可根据目的蛋白分子量适当调整,小蛋白短一点,大蛋白长一点);
7) 转膜过程会产生大量的热,整个转膜装置需要冰浴。操作结束后将玻璃板洗干净,避免胶粘附在玻璃板上。

5. 封闭:常用封闭液5%BSA或脱脂奶粉,将膜在摇床上最慢速封闭1h。
注:磷酸化蛋白(除丝氨酸磷酸化外)的检测不能用脱脂奶粉,脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,使用会造成高背景。
6. 一抗孵育:一抗与抗原特异性结合,特异性识别目的蛋白。
1) 一抗根据说明书配比稀释(稀释液可选择5%脱脂奶粉或者一抗稀释液)
2) 把封闭好的膜在TBST中洗3遍,速率60~100,每次5~10min(5%脱脂奶粉稀释省略该步骤)
3) 一抗封膜之后然后放入4℃环境中最慢速摇过夜(>8h)
4) 回收一抗,TBST快摇洗膜3次,速率60~100,5~10min/次
7. 二抗孵育:二抗带有酶或同位素标记等可以被检测出的标记,与一抗结合,与一抗的类别或者亚类相匹配。Western Blot常用辣根过氧化物酶标记的二抗,形成HRP一抗结合物,而后用来显影。
1) 二抗根据说明书配比稀释(稀释液选择TBST)
2) 将膜放入配好的二抗中,摇床上最慢速摇孵育1h
3) 弃二抗,TBST快摇洗膜3次,速率60~100,5~15min/次(可多洗一次)
8. 显影:增强化学发光法(ECL)运用氨基苯二酰肼类主要是鲁米诺及异鲁米诺衍生物。鲁米诺在免疫测定中既可用作标记物,也可用作过氧化物酶的底物,在ECL底物中,含有H2O2和鲁米诺,在HRP(辣根过氧化物酶)的作用下显色。
1) 配置显影液(A液:B液=1:1),准备红色的灯(灯离胶片远一点)、压片盒和胶片将膜取出,沥水(膜不能干),放在压片盒内;
2) 显影液滴于PVDF膜上,若肉眼能看见荧光放上胶片后立即移开,一般情况下放上胶片关闭压片盒压不同时间多次压片;
3) 拿出胶片,放入显影仪中显影。
流程图:

Western Blot可能的失败原因分析:
1、极端情况:无任何信号(白板,什么图像都没有)
可能的原因:一抗二抗不匹配、抗体浓度太稀或失效、上样量太少、蛋白降解、转膜转过了或者没转上、显影时间太短、显影液失效。
2、杂带太多
Ø 分得清目的条带
可能的原因:可能是多克隆抗体,可选择更换为单克隆抗体。
Ø 分不清目的条带
可能的原因:抗体特异性差,抗体质量有问题,进行售后。
Ø 条带信号非常强,难以分辨
可以改进的方法:降低一抗稀释浓度、降低蛋白上样量、稀释显影液。
3、条带上游圆形的白孔
可能的原因:转膜的时候没将气泡赶干净、孵育抗体接触不良(孵育盒中放太多张膜、抗体液体中有气泡)。
4、膜上有很多杂质,黑色小颗粒
可能的原因:洗涤次数时长不够、封闭液中有杂质。
5、高背景
可能的原因:二抗浓度过高。
6、背景脏,不规则的成片背景
可能的原因:未进行非特异性封闭或封闭不充分、二抗与封闭剂非特异性结合或反应、多张膜一起孵育洗涤、操作失误(膜接触过不该碰的其他东西,比如掉到桌子上、手碰了等)。
7、“微笑”条带
可能的原因:电泳电压过高、电泳温度过高、胶凝固不均匀(TEMED没混匀)、梳子没拔好有胶粘连。
8、拖尾条带
可能的原因:分离胶浓度过大、蛋白样品降解、电泳液反复使用多次。