2019年12月16日,威廉(中国)任艾明课题组与奥地利因斯布鲁克大学Ronald Micura教授课题组合作在Nature Communications上发表题为“SAM-VI riboswitch structure and signature for ligand discrimination”的研究论文。
核开关是一类位于mRNA 5'端序列高度保守的非编码RNA分子,一般含有两个功能模块:适配体结构域(Aptamer Domain)和表达平台(Expression Platform)。适配体结构域通过结合相应的配体,自身构象发生改变,进而诱导表达平台构象变化,在转录水平或者翻译水平调控下游基因的表达。最早的核开关于2002年被报道,迄今已经发现约有近40种,绝大多数存在于细菌中。
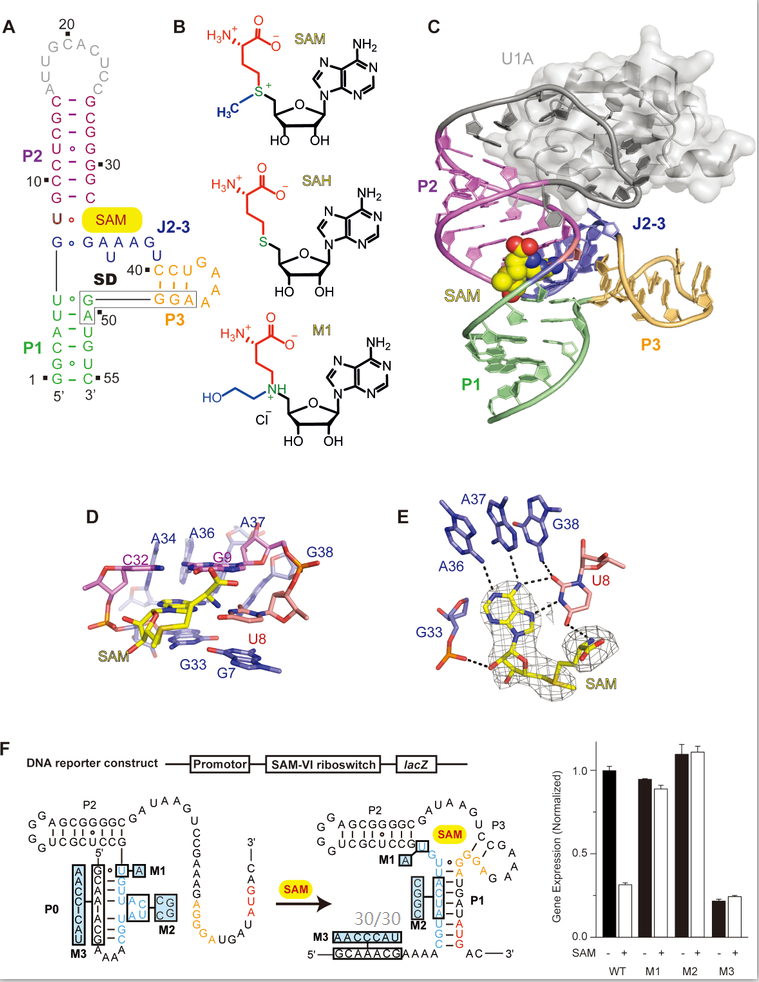
S-腺苷甲硫氨酸(S-adenosylmethionine, SAM),是生物体内的一类重要的小分子代谢物,在不同生物种属均发挥至关重要的作用。SAM核开关特异性识别SAM,是目前种类最多的一类核开关,分为SAM-I、SAM-IV、SAM-I/IV、SAM-II、SAM-V、SAM-III、SAM-VI等多个亚型。 SAM-VI核开关是2017年被鉴定出的一类新型核开关,可以特异性地识别SAM,而对与SAM结构类似仅少一个甲基的代谢产物SAH响应很弱。二级结构显示,SAM-VI核开关含有三个茎区(Stem)P1、P2和P3,它们连接在同一个大内环上,形成一个三通路(3-way junctional)的RNA结构。 茎区P3长度相对较短,与茎区P1直接相连,核糖体结合位点SD序列就处于茎区P1和P3的连接区域(图A)。
为了阐明SAM-VI核开关的配体识别机制,任艾明课题组利用X-射线晶体学的方法,解析了野生型SAM-VI核开关与SAM、SAH以及SAM类似物M1(化学结构如图B)等一系列复合物的三维结构。三维结构显示,SAM-VI核开关茎区P1和P2以及参与配体识别的内环上的碱基连续堆积形成长双螺旋轴, 茎区P3与该长轴几乎垂直相交,而配体SAM就结合在P3与长轴相交的内环区(图C)。对SAM识别口袋的结构分析显示,配体SAM的腺苷与内环区碱基U8形成经典Watson-Crick配对,该碱基对进一步被A36/A37/G38特异性识别,并通过堆积作用参与长轴形成(图D,图E)。SAM的糖环以及配体末端的α-氨基也分别与碱基G33和U8形成氢键作用被固定于口袋外侧(图E)。通过对结合口袋进行碱基特异性突变以及ITC结合实验,进一步验证了SAM-VI核开关对SAM特异性识别的结构特征,同时也揭示了SAM-VI核开关倾向于结合SAM而不是SAH的原因。
综合序列保守性分析发现在SAM-VI核开关在茎区P1的5'端存在部分碱基可能与三维结构研究中发现的茎区P1中的关键碱基相互配对形成茎区P0,进而阻止含有茎区P1的结合状态结构的形成,释放SD序列,启动后续基因表达。课题组基于体外的Ap标记实验以及体内的LacZ报告基因实验,完美得验证了茎区P0参与的SAM-VI核开关的作用机制,建立了新的核开关调控模型(图F)。当细胞内SAM浓度偏低时,SAM-VI核开关形成茎区P0,此时SAM-VI核开关的SD序列被释放,启动下游的基因表达;当细胞内SAM浓度增高时,SAM-VI核开关结合SAM,茎区P1形成,SD序列被固定于复合物结构中,SAM-VI核开关下游基因表达被关闭。与不含有茎区P0的序列相比,茎区P0的存在可以更有效的调控相关基因的关闭和启动(图F)。
以上工作首次解析了新型核开关SAM-VI的三维结构,揭示了其与配体高特异性结合的分子机制,进一步丰富了RNA分子的结构数据库;首次发现和验证了新型元素核开关5'端序列参与基因表达调控的模型,推动了核开关领域的进一步发展;SAM类似物M1的复合物结构研究,为SAM-VI核开关以及M1在RNA化学和合成生物学上的应用提供了理论基础。
基金支持
该研究工作获得了国家自然科学基金(31870810,91940302,91640104 和31670826),浙江省杰出青年基金(LR19C050003)以及浙江大学中央高校基金科研项目业务费(2017QN81010)等项目的资助。威廉(中国)博士后孙爱爱博士为本论文共同第一作者。