2018年11月1日,威廉(中国)宋海教授实验室联合香港中文大学生物医学学院Dr. Kingston Mak实验室在Nature Communications杂志在线发表题为“Reciprocal inhibition of YAP/TAZ and NF-κB regulates osteoarthritic cartilage degradation”的研究论文,发现YAP/TAZ与NF-κB在骨关节炎中的相互调控机制。
骨关节炎(osteoarthritis, OA)是由于滑膜关节的退变引起的以关节疼痛、僵硬和活动受限为特征的关节病变,伴随有炎症反应,关节软骨降解,软骨下骨反应性增生和骨赘形成等生理症状,最终导致关节运动机能丧失。迄今为止,对关节软骨在炎症,机械刺激及分解代谢等领域的研究已有很大的进展,但如何改变OA的病理进程仍是一个挑战。另外,OA的病程是逐渐发展的,目前没有任何一种药物及保留关节的手术可以逆转其发展的病程。因此,系统研究OA的发生、发展及病理过程对寻找新的、有效的诊断和治疗方法具有重要意义。
宋海课题组联合香港中文大学生物医学学院Dr. Kingston Mak课题组的研究发现,在关节炎发生时,Hippo信号通路关键蛋白YAP在关节软骨中的表达明显降低,并且在关节炎病人样本中,YAP的表达水平随着关节损伤程度的增加而逐渐降低。通过转基因和基因敲除小鼠模型的实验,研究者发现软骨组织特异性过表达YAP可以缓解关节软骨的损伤,并抑制炎症因子TNFα和IL-1β诱导的关节炎相关基因MMP3、MMP9、MMP13、ADAMTS4/5等的表达;反之,在软骨中特异性敲除YAP可加速关节软骨的降解,促进骨关节炎的发生。通过一系列分子机制研究,研究者发现炎症因子TNFα、IL1-β促进YAP/TAZ蛋白酶体途径的降解,进而抑制YAP/TAZ的转录活性,而且YAP/TAZ的降解可以不依赖于经典Hippo信号通路。进一步,作者发现,蛋白激酶TAK1可以诱导YAP/TAZ磷酸化,并促进YAP/TAZ与β-TRCP结合,进而通过泛素化途径降解。另一方面,YAP/TAZ也可通过与IKKs形成复合物,抑制IKKα/β的磷酸化与激活,进而抑制NF-κB信号通路的激活,发挥抑制关节软骨降解的功能。该项研究不仅有助于进一步阐明OA发生、发展的分子机制,而且为有效治疗OA提供了新的思路。
该研究由浙江大学宋海实验室和香港中文大学Dr. Kingston Mak实验室共同完成,宋海实验室博士后邓玉杰为该论文第一作者,宋海教授和Dr. Kingston Mak为共同通讯作者,威廉(中国)为论文第一作者单位。此项研究受到国家自然科学基金面上项目、青年项目,浙江省自然科学基金以及博士后国际交流计划引进项目的资助。
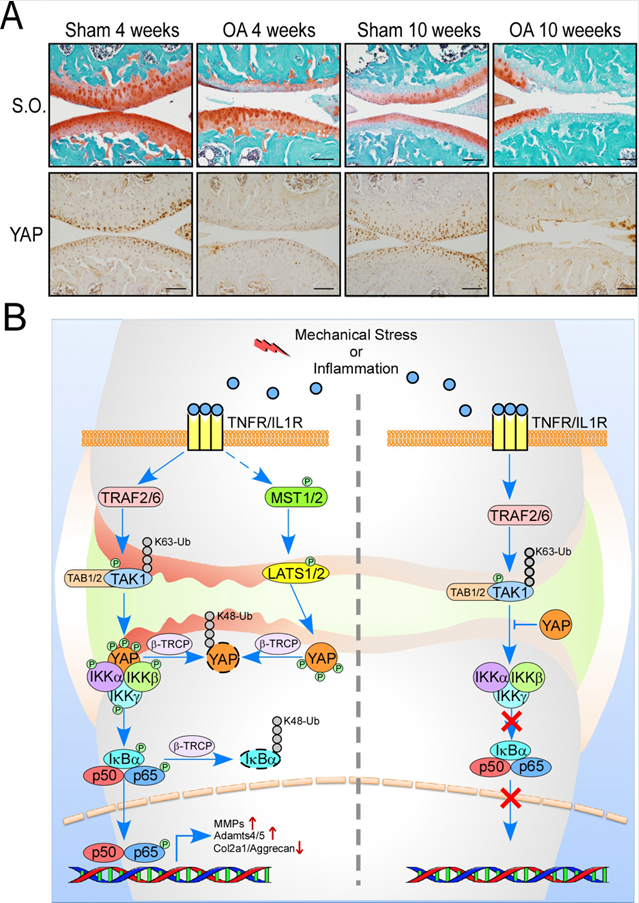
图片说明:A:在小鼠骨关节炎模型中,随着疾病的进展,关节软骨中YAP蛋白表达量逐渐减少。B: Hippo-YAP/TAZ通路与NF-κB信号通路相互拮抗的分子机制。
原文链接: https://www.nature.com/articles/s41467-018-07022-2